Összefoglaló közlemények / Reviews
Conservative treatment modalities of perianal fistulizing Crohn’s disease
Summary
Perianal fistulas are well known complications of Crohn’s disease (CD), and can be associated with significant morbidity and reduced quality of life. Different classifications describing perianal fistulas mostly are based on their relationship to the external and internal anal sphincters. Optimal management of perianal fistulizing CD requires a collaboration between gastroenterologists and surgeons. Current medical management based on antibiotics, biologic agents and immunomodulators. Despite the introduction of biologic medical therapies, the best fistula healing rates reported with combined medical and surgical approaches are approximately 50%. Newer cell based therapy raising new hopes for better outcomes.
A perianalis fisztulák a Crohn-betegség ismert szövődményei, jelentős morbiditással és életminőség-romlással járnak. Különböző osztályozások léteznek, amelyek alapvetően a külső és belső anális sphincterhez való viszonyon alapulnak. A perianalis fisztulák optimális kezeléséhez a gasztroenterológus és sebész együttműködése szükséges. A gyógyszeres kezelés előterében az antibiotikumok, a biológiai szerek és az immunmodulátorok állnak. A hagyományos, biológiai gyógyszeres és sebészi kezelések ellenére a legjobb eredmények 50% körüli fisztulagyógyulást mutatnak. Az új sejtterápiás kezelési lehetőségek reménykeltőek a kedvezőbb kimenetel eléréséhez.
Bevezetés
A perianalis fisztulák és szövődményeik a Crohn-betegség ismert, sajátos megjelenési formáját képezik, jelentős morbiditással járnak, és kifejezetten rontják a beteg életminőségét. A betegség lefolyása során a betegek 25%-ában jelenik meg (1). A fisztula jelenléte rossz prognosztikai faktort jelent, a betegek 70%-a igényel sebészi ellátást (2). A fisztulák kumulatív incidenciája 10 év után 33%, 20 év után 50% (3). Évekkel megelőzhetik a bélgyulladást, 10%-ban kezdeti tünetként jelenhetnek meg (4). A perianalis fisztulák megjelenése növeli az agresszív lefolyású Crohn-betegség kockázatát.
Meghatározás, osztályozás és diagnózis
A perianalis fisztula abnormális kommunikációt jelent a rectum, illetve az anális csatorna és a külső perianalis, illetve az ischio-anális bőrfelszín között, rendkívül változatos megjelenéssel. A Crohn-betegséghez asszociált fisztulák kialakulási mechanizmusa alapvetően eltér az egyéb etiológiájú fisztulákétól, meghatározó benne a bélben kialakult gyulladás szerepe, amely kifelé törve alakítja ki másodlagosan a fisztulát és az esetleg jelenlévő abscessust. A fisztulák osztályozása során a Parks-klasszifikáció az anus záróizomzatához való viszony alapján történik (5) (1. táblázat), azonban nem minden fisztula sorolható be ezen osztályok valamelyikébe. A gyakorlat, elsősorban a kezelés szempontjából a fisztulák szimplex és komplex csoportba osztályozása terjedt el (Steele SR, Kumar R, Feingold DL, Rafferty JL, Buie WD; Standards Practice Task Force of the American Society of Colon and Rectal Surgeons. Practice parameters for the management of perianal abscess and fistula in ano Dis Colon Rectum 2011; 54(12): 1465–1474.). A szimplex fisztulák kezelése elsősorban sebészi feladat (fistulectomia, Seton-átfűzés stb.), míg az úgynevezett komplex fisztulák interdiszciplináris együttműködést igényelnek. Ezeket magas intersphincterikus, transsphincterikus, extrasphincterikus vagy suprasphincterikus elhelyezkedés jellemez, többszörös külső nyílással, gyakran abscessusra utaló fájdalommal és fluktuációval vagy rectovaginalis fisztulával és anorectalis szűkülettel.
A pontos diagnózis, az anatómiai jellemzés és aktivitás meghatározása fizikális vizsgálattal és kismedencei-MR valamint endoszkópos ultrahang alkalmazásával történik (EUS). Amennyiben rendelkezésre áll, a követés során hasznos lehet perinealis ultrahang elvégzése is. A fizikális vizsgálat, anesztéziában történő vizsgálat, valamint egy képalkotó társítása 85-100% pontossággal alkalmas a fisztulák feltérképezésére, osztályozására (6).
1. táblázt: A perianális fisztulák osztályozása Crohn-betegségben
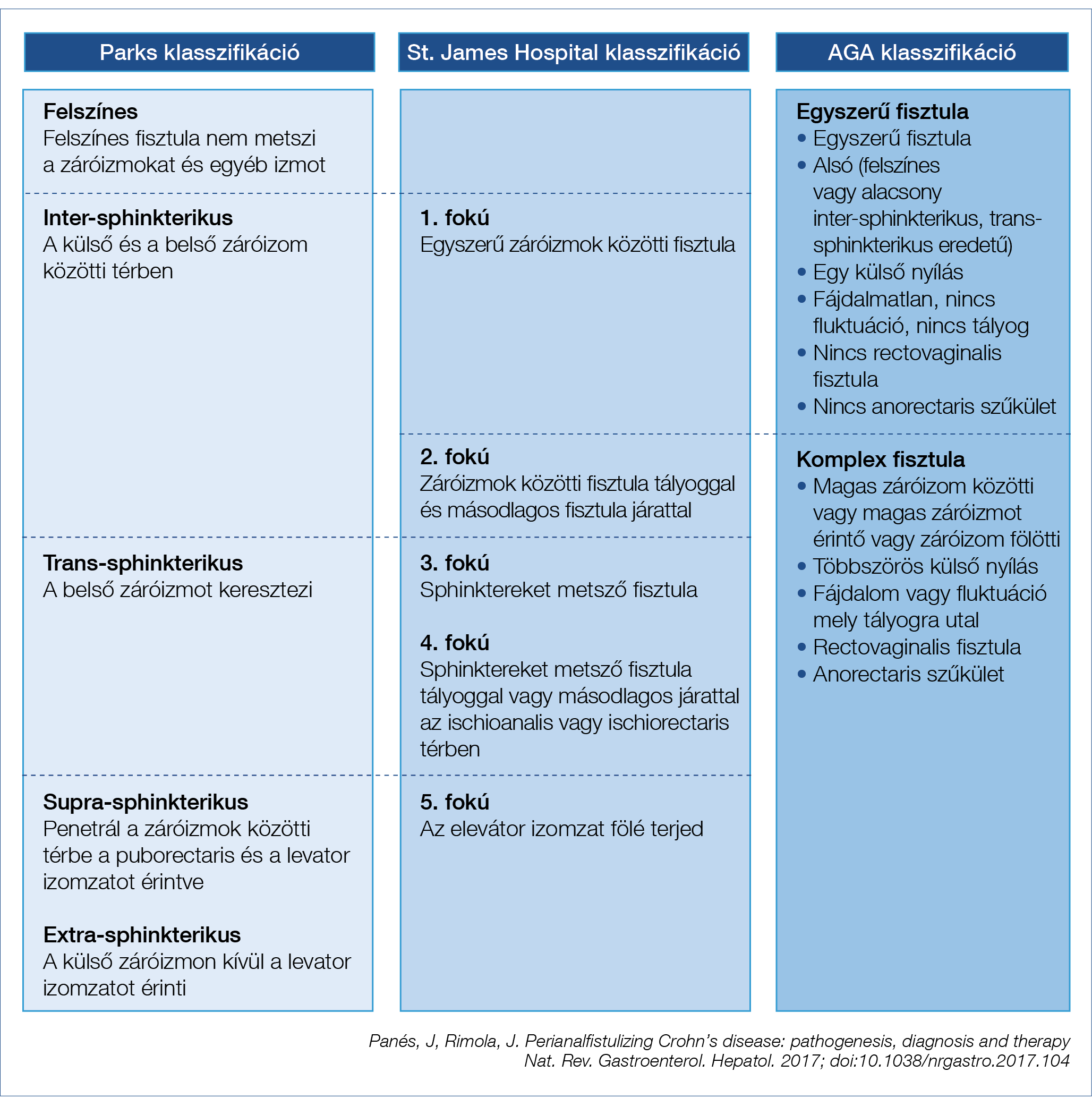
A komplex perianalis fisztulák kezelése jelenleg is nagy kihívást jelent, a kezelés megszakítása magas rekurrencia rizikóval jár, továbbra is jelentős a végleges székletdiverzió, vagy a rectumamputáció aránya. A fisztulizáló Crohn-betegség önmagában is súlyos kimenetel egyik rizikófaktora (4).
Az aktív rectalis gyulladás jelenleg is fontos tényezője a patogenezisnek, lehetetlenné téve a fisztula záródását, gyógyulását, tehát a nyálkahártya-gyógyulás és ennek eléréséhez szükséges optimalizált gyógyszeres kezelés fontos eleme a kedvező eredmények elérésének (7). Ennek előfeltétele a sebészi beavatkozás, amely során a krónikus gyulladás következtében kialakult mechanikus akadályok elhárításra kerülnek. A kombinált gyógyszeres sebészi kezelés nyújtja a legjobb lehetőséget a fisztulák hosszú távú, sikeres kezelésére (8).
A fisztulák gyógyszeres kezelése
Az aminoszalicilátoknak nincs helye a fisztulák és általában a Crohn-betegség kezelésében.
A kortikoszteroid-kezelés szintén nem javasolt a fisztulák kezelésére, azok záródását nem segíti elő, ugyanakkor az abscessus kialakulásának rizikója lehet (9).
Konvencionális kezelés
Az antibiotikum-kezelés (ciprofloxacin vagy metronidazol) 4-12 hetes alkalmazása több randomizált, kontrollált vizsgálat (RCT) eredménye szerint szignifikánsan csökkentette a fisztulák váladékozását (10). Ugyanakkor ez a hatás nem bizonyult tartósnak a kezelés leállítását követően (11). Ellentmondásosak az adatok az anti-TNFa-val történő kombinációs kezeléssel kapcsolatban, a hathónapos utánkövetés során nem észleltek különbséget (12, 13). Az eredmények csak két antibiotikumra vonatkoznak, a továbbiak esetlegesen kedvező hatása kétséges. A bizonyítékok alapján a metronidazol és a ciprofloxacin alkalmas lehet kezdeti bevezető kezelésre, csökkentheti a drenázsigényt, megelőzheti az abscesszus vagy a szeptikus szövődmények kialakulását (14).
A thiopurinok (azathioprin, 6-merkaptopurin) alkalmazására vonatkozóan több adat van, de prospektív vizsgálatból származó eredmények nem támogatják. Egy metaanalízis, amelyben a fisztulazáródást követő vizsgálatok szerepelnek, a klinikai választ 54%-nak találták azathioprin esetében, szemben a placebo 21%-ával (14). Ezek az eredmények fenntartásokkal kezelendők, mivel a válasz meghatározása változó, és a valódi fisztulazáródási arány nehezen értelmezhető. Jelenleg általános vélemény, hogy alternatív lehetőségek birtokában az azathioprin önmagában nem elégséges a fisztulák kezelésére, ugyanakkor fontos lehet az anti-TNFa-kezeléssel kombinációban.
Calcineurin-inhibitorokkal és methotrexatkezeléssel kapcsolatban kevés adat áll rendelkezésre, elsővonalbeli kezelésük nem ajánlott.
Anti-TNFa-kezelés
Két prospektív vizsgálatban követték az infliximab hatását fisztulizáló Crohn-betegségben. Az infliximab hatékonynak bizonyult a fisztulazáródás kialakulásában (komplett záródás 55% IFX mellett szemben a placebocsoport 13%-ával) és fenntartásában egyéves kezelés során (36% IFX-kezeléssel szemben 19% placebo mellett) (15, 16). Az adalimumab hatékonynak bizonyult a fisztulazáródás fenntartásában kétéves kezelés során (17). Bár a rendelkezésre álló bizonyítékok nem erősek, az anti-TNF kedvező hatása mégis egyértelmű. Fisztulaspecifikus végpontú randomizált kontrollált vizsgálati eredmény az infliximabra vonatkozóan létezik, de az adalimumab hatásossága is bizonyítottnak tekinthető.
Az infliximabkezelés leállítását követően a fisztulazáródás átlag 14 hétig maradt meg, és a betegek 60%-ában következett be hatásvesztés 54 hetes követés során (16, 18). Adalimumabkezelés hosszú távú követése során a fisztulazáródás négy évig fenntartható volt (19). Hosszabb távú infliximab vagy adalimumabkezelés ajánlott mielőtt annak hatástalanságáról nyilatkoznánk (20). A tüneti válasz is fontos eredménynek számít, de a kezelés felfüggesztésére csak képalkotóval bizonyított záródást követően kerülhet sor, figyelembe véve, hogy a fisztulák rossz prognosztikai faktornak számítanak. Összességében az indukciós infliximab- vagy adalimumabkezelésre jól reagáló betegek esetében hosszú távú fenntartó kezelés javasolt.
Az elmúlt években több adat jelent meg elsősorban az infliximab vonatkozásában a szérumgyógyszerszint és a klinikai hatékonyság összefüggéséről luminális Crohn-betegségben. A mérési technikától függően, de többnyire a >3 mg/ml gyógyszerszint jól korrelál a kedvező kimenetellel (21). Kérdéses, hogy mindez érvényes e fisztulizáló formákra, érdemes-e dózist emelni, illetve van-e értelme nagyobb adagok használatának. Present és munkatársai vizsgálatában az adatok nem támogatják a dózisemelést, a 10 mg/kg adag nem bizonyult hatékonyabbnak mint a szokványos 5 mg/kg sem a fisztulaváladékozás csökkenésében, sem a fisztulazáródásban (15). Ugyanakkor újabb vizsgálati adatok azt bizonyítják, hogy a fisztulagyógyulást mutató betegekben magasabb volt a széruminfliximab szint, mint a váladékozó fisztulák esetében (6,0 vs. 2,3 mg/ml, p<0,001). Hasonló tendenciát észleltek a szérumadalimumab szintek esetében is a záródott fisztulák és az aktív fisztulák összehasonlításánál (7,4 mg/ml szemben 4,8 mg/ml) (22). Tehát a luminális Crohn-betegségben elfogadott terápiás szintnél jóval magasabb anti-TNFa-értékek szükségesek a fisztulazáródás eléréséhez (23).
Anti-TNFa-kezelés és antibiotikum, immunmoduláns kombinációval
Egy kisebb prospektív vizsgálat az adalimumab és ciprofloxacin kombináció kedvező hatásáról számol be a fisztulák záródását illetően 12 hét után az adalimumab és placebo kombinációhoz képest (65% szemben a 33%-kal), ami az antibiotikum-indukciós kezelésben játszott szerepére utal (24). Ismert, hogy luminális Crohn-betegségben az azathioprin + infliximab kombináció hatékonyabb, mint ezek a kezelések monoterápiában alkalmazva (25). Bár magas minőségű bizonyítékot jelentő adat nem áll rendelkezésre komplex perianalis fisztulák esetében, a kombinált kezelés javasolható a Crohn-betegség ezen súlyosnak minősülő formáiban.
Vedolizumab
A vedolizumab (VDZ) alfa-4-béta-7 integrinellenes humanizált IgG1 monoklonális antitest, amely szelektíven gátolja a leukociták átjutását a bélfalon. A Gemini2-vizsgálatban, amely kis számban fisztulizáló Crohn-betegeket is tartalmazott, a 8 hetente folytatott kezelés hatékonyabbnak bizonyult, mint a placebo, vagy a négyhetente alkalmazott fenntartó kezelés a fisztulazáródást illetően (26). Egy francia obszervációs vizsgálatban, amely 35 fisztulizáló Crohn-beteget is tartalmazott, 42,9%-ban észleltek teljes záródást a 14. héten, és a betegek 34,3%-a az 54. héten is komplett remisszióban maradt (27). Egy 151 beteget magába foglaló retrospektív multicentrikus kohorszvizsgálatban a betegek 65%-ában megszakították a kezelést átlag 30 hét után hatásvesztés vagy hatástalanság miatt. A betegek 22%-ában záródtak a fisztulák, és 31%-ban rekurrencia jelentkezett a kezdetben nyugalomban levő fisztulák esetében a vizsgálat során (28). A jelenleg rendelkezésre álló adatok alapján a vedolizumab alkalmazható azon betegek esetében, akiknél az anti-TNFa hatásvesztést mutat vagy intolerancia észlelhető.
Ustekinumab
Az ustekinumab (UST) az interleukin-12 és -23 p40 alegységét blokkoló monoklonális antitest, amelynek a szisztémás gyulladáscsökkentő hatása gyulladá-
sos bélbetegségekben, elsősorban középsúlyos súlyos Crohn-betegségben (29). Az alapvizsgálatokat jelentő UNITI-programban alacsony volt az aktív fisztulizáló
Crohn-betegek aránya (10,8%), de az esetek 80%-ában észleltek választ szemben a placebocsoportban észlelt 45,5%-kal (30). Több obszervációs kohorszban észleltek kedvező hatást: egy kisebb kanadai vizsgálatban hathónapos kezelés során 66%-os volt a fisztulaválasz (a fisztulák számának 50%-os csökkenése) és 33%-os a fisztulazáródás és a komplett gyógyulás, a GETAID-csoport a betegek 67%-ában észlelt szignifikáns javulást (31, 32).
Az ustekinumab másodvonalbeli kezelésnek számít perianalis fisztulizáló Crohn-betegségben a vedolizumabhoz hasonlóan. Mindkét gyógyszer esetében további prospektív adatokra van szükség a terápiás algoritmusban való elhelyezéshez.
Lokális biológiai kezelés
A gyulladáscsökkentők, így az anti-TNFa lokális alkalmazása jól ismert a reumatológiában is (33). Több beszámoló létezik kis betegszámú vizsgálatban észlelt kedvező eredményekről az infliximab lokális alkalmazását követően. Változó mennyiségben, ismételten alkalmazva (4-6 hetente) 87,5%-os arányban értek el fisztulazáródást egyéves követés során (34). Az adalimumab 20 mg-os hígított adagja a fisztulajáratba fecskendezve kéthetente, 18 hónap átlagos kezelési idő során 12-ből 9 betegben vezetett a váladékozás megszűnéséhez (35). A biztató eredmények ellenére, figyelembe véve a kis betegszámot, a változatos körülményeket, a standardizált metodika hiányát, a módszerrel kapcsolatban komoly fenntartások merültek fel.
Mesenchimális őssejtkezelés
A lokális őssejtkezelés hatékonynak mutatkozott korábbi kezelésre refrakter komplex fisztulák kezelésében. A terápia eredményességét egy nagy betegszámú randomizált kontrollált vizsgálat bizonyítja. Az allogén mesenchimális őssejtpreparátum alkalmasnak bizonyult fisztularemisszió indukcióra komplex perianalis fisztulákban. A teljes remissziós ráta szignifikánsan magasabb volt a placebóhoz képest a kezelés 24 hetében (50% vs. 34%; p=0,024), és az egyéves relapszusarány szignifikánsan alacsonyabb volt ebben a csoportban (25% vs. 44%) (36). A kezelésekre előzetes sebészi beavatkozást követően került sor, úgynevezett kondicionálás során a fisztulák falát felfrissítették (curettage), az abscessusokat drenálták, és szükség szerint setonokat alkalmaztak. Valószínűleg a hatékony sebészi előkészítés magyarázza a magas placebo remissziós rátát rövidtávon, amely gyógyszeres kezelés nélkül alakult ki. Az őssejtkezelés hatékony terápiás alternatíva lehet, hatékony fenntartó kezelés esetén (a gyógyszer törzskönyve alapján, inaktív/kismértékben aktív intraluminális betegség esetén) arra nem reagáló fisztulák zárására (a váladékozás megszűnése a külső nyílások záródásával, amit az MRI is megerősít), amennyiben a komplex fisztulák állapota nem túl előrehaladott (mind a fisztulák száma, mind a külső és belső nyílások száma, mind a fisztula lokalizációja, mind a hegesedés mértéke limitálhatja a kezelés alkalmazhatóságát).
Egyéb kezelési lehetőségek
A hiperbárikus oxigénkezelés pontos mechanizmusa nem ismert, valószínűleg az oxidáció segíti az anaerob baktériumok elpusztítását fagocitálás révén, és segíti a szöveti regenerációt (37). Sebészeti beavatkozással kiegészítve 37,5%-os parciális fisztulazáródást és ugyanilyen arányú komplett fisztulazáródást észleltek 20 napon át végzett napi kétórás kezelés során (38).
Felmerült az aktív szén potenciális kedvező hatása, azáltal, hogy eltávolítja a toxikus, gyulladásos anyagokat pl. TNFa-t is. A vizsgálati eredmények ellentmondásosak, egyértelmű megerősítést nem nyert a pozitív hatás (39, 40).
Az endoszkópos kezelési technikák (endoszkópos fistulotomia, drenázs, klipp felhelyezése, varrat létrehozása, vagy a különböző injekciós terápiák) alkalmazása csak alapos endoszkópos felmérést követően jöhet szóba. Az ilyen irányú tapasztalatok hiányosak, az eredmények ellentmondásosak. Ugyanakkor a fisztulajárat epithelizációja, a gyulladás és a fibrózis jelenléte, valamint a jól meghatározott technikák hiánya komoly limitáló tényező, így ezek rutinszerű használata nem javasolható (41).
A modern sebészi technikák a nem Crohn-eredetű fisztulákban kerültek kezdetben kipróbálásra, de Crohn-betegségben egyszerű fisztulák esetén, illetve körülhatároltan komplex fisztulákban korán alkalmazhatók az anorectalis működés megtartása és az inkontinencia elkerülése érdekében. A LIFT (ligation of the inter sphincteric tract), vagy a VAAFT (video assisted anal fistula treatment) technikák igényes diagnosztikát követően alkalmazható beavatkozások, amelyek eredményességére vonatkozóan több adat szükséges (42, 43). Hasonló mondható el a CO2-lézertechnika alkalmazásáról, amely gyors javulást ígér a sphincter megtartásával (44).
Egy másik záróizom-megtartó technika a fibrinragasztó injekció lokális alkalmazása. Ez egy kétkomponensű anyag, egyrészt fibrinogén, faktor XIII, plazminogén és aprotinin, másrészt thrombin, amelyek együttes beadása után a szöveti gyógyulás felgyorsul elzárva a fisztulát. A beadás előtt a szetonok eltávolítása és curettage szükséges, ami a hatékonyságot növelheti (45).
Az anális fisztuladugók olyan felszívódó anyagokat jelentenek, amelyek a fisztulákat kitöltve a gyógyulást fokozhatják. Az egyik egy liofilizált porcin intesztinális submucosa a másik egy szintetikus poliglikolsav és trimetilén-karbonát keverék. Egy nagy betegszámon (106 beteg) végzett prospektív randomizált tanulmány nem mutatott jobb eredményeket a kontrollhoz képest, amely a szetoneltávolítást követően a korábban alkalmazott gyógyszeres kezelést kapta (46).
A perianalis fisztulizáló Crohn-betegség kezelési stratégiája
A komplex fisztulák pontos elhelyezkedésének és állapotának felmérését követően, a gyógyszeres kezelés elkezdése előtt javasolt a sebészi vizsgálat és szükség szerinti beavatkozás (pl. drenálás), amely hatékonyabbá teheti a gyógyszeres kezelést. A kombinációs kezelés bizonyítottan javítja az eredményeket. Szisztémás összehasonlító vizsgálat eredményei alapján, míg a gyógyszeres kezelés önmagában 43%-ban vezetett fisztulagyógyuláshoz, addig a sebészi kezeléssel kombinálva ez az arány 53%-ra emelhető (47). A betegek nagyobb részénél kisebb beavatkozás szükséges (abscessus drenázs, fistulotomia/fistulectomia, vagy setonbehelyezés), de közel az esetek egyharmadában komplexebb sebészi beavatkozás szükséges. Az úgynevezett egyszerű fisztulák esetén is kötelező az előzetes sebészi vizsgálat, amely néha önmagában is elégséges lehet tüneti kezelésre.
A gyógyszeres kezelésre refrakter esetekben az alkalmazott kezelés revíziója szükséges. A sebészi konzultációt megelőzően a kezelést optimalizálni kell. Ebben segít az anti-TNFa gyógyszerszint és a gyógyszerellenes antitestek szintjének meghatározása. Ezek segítenek a terápiás döntéshozatalban és szükség esetén a dózisoptimalizációban. Amennyiben az emelt dózisú kezelés nem hatékony, a sebészi szövődmények lehetőségét ki kell zárni, illetve ezeket szükség esetén el kell hárítani. A perianalis fisztulázó betegek 70%-ában szükséges valamilyen sebészi beavatkozás, durván egyharmadában bélreszekcióra kerülhet sor (1). A sebészi gasztroenterológiai együttműködés hozhatja a jelenleg rendelkezésre álló lehetőségek mellett az optimális eredményt. A sebészi vizsgálat során kimutatható lehet nem drenáló fisztula, abscesszus, amelynek megoldása alapfeltétele a további sikeres kezelésnek. Nagyon súlyos esetekben proctectomia vagy székletdiverzió válhat szükségessé ileostomiával vagy colostomiával. A székletdiverziók kohorszvizsgálatainak metaanalízise a betegek 63,8%-ában mutat korai javulást a kezelésre, ugyanakkor a bélkontinuitás helyreállítása az esetek 34,5%-ában volt megpróbálható, és csak 16,6%-ában volt sikeres (48).
1. ábra: Az aktív perianalis fisztulák kezelése. Toronto-konszenzus
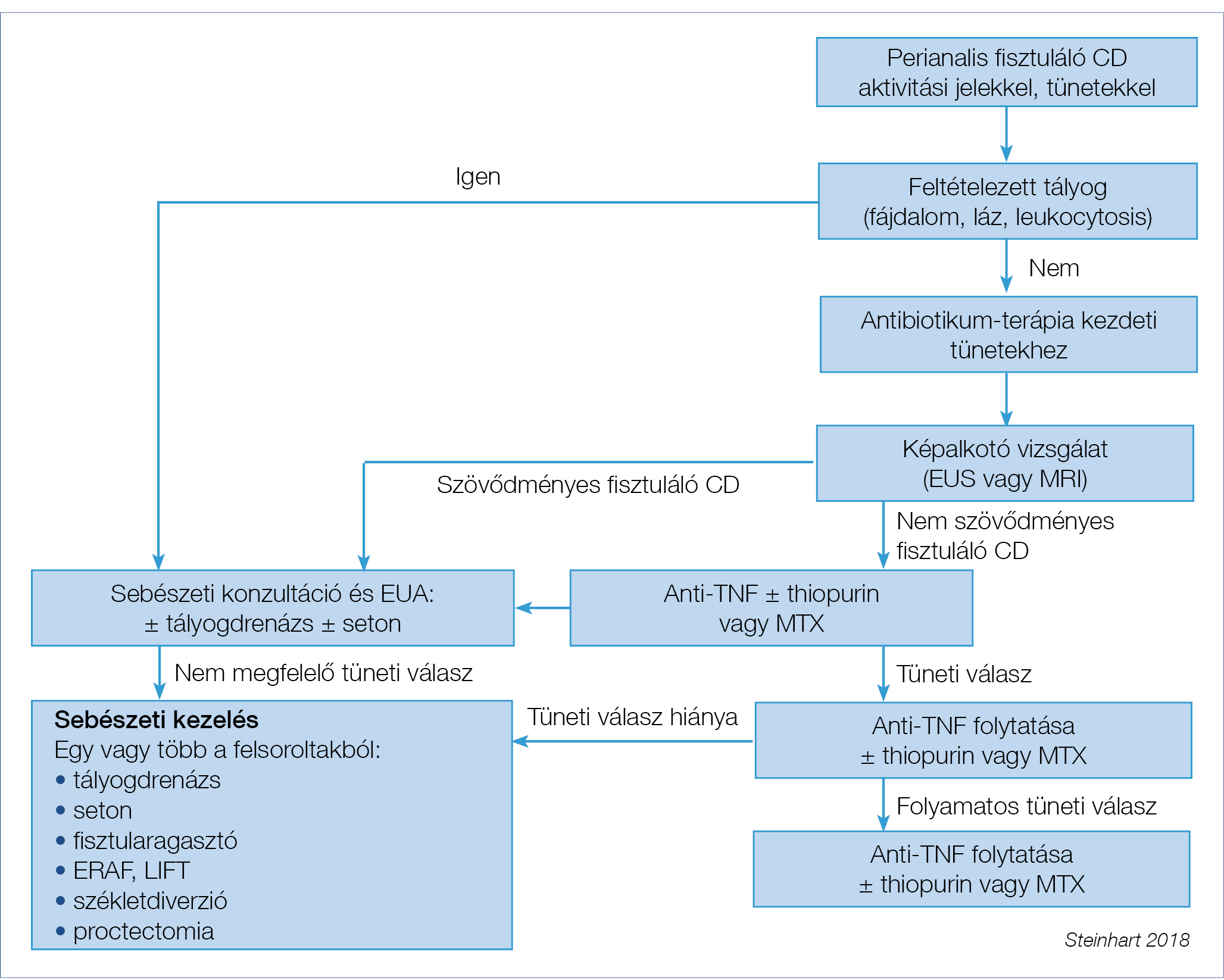
Az optimális kezelési stratégia alapvető eleme a gasztroenterológus és sebész szoros együttműködése, amelynek keretében a megfelelő időbeni illesztéssel egymást segítve alkalmazásra kerülnek az evidenciák alapján hatékony gyógyszeres és sebészi módszerek.
Jelenleg a bevezető antibiotikum-kezelés mellett az anti-TNFa-kezelés tekinthető bázisterápiának, szükség és lehetőség szerint immunmoduláns, elsősorban azathioprinkezeléssel kiegészítve. Amennyiben ez nem hatékony vagy hatásvesztés következik be, második vonalban egyéb biológiai terápiák kipróbálása lehetséges.
Hatékony fenntartó kezelés mellett a terápiára nem reagáló komplex perianalis fisztulák esetében a megfelelő kritériumok teljesülése esetén mesenchimális őssejt-transzplantáció lehetősége rendelkezésre áll. Fontos feltétel a legalább hat hete drenáló fisztula és a maximálisan két belső nyílás és három külső nyílás jelenléte a klinikai vizsgálat és az MRI alapján.
Az elért eredmények objektivizálásának eszközei a képalkotó vizsgálatok (MR, endoszkópos ultrahang) rendszeres, megfelelő időben történő alkalmazása hozzájárul a terápia optimalizálásához. A kezelésre és a követésre vonatkozó algoritmust a 1. ábra mutatja be (49).
A gyógyszeres kezelésre vonatkozó, rendelkezésre álló evidenciák szegényesek, a legerősebbek az RCT-alcsoport-analízisekből származnak. A jövőben kiemelten a perianalis fisztulákra tervezett randomizált kontrollált vizsgálatok szükségesek a megfelelő erősségű evidenciák érdekében.
2. Beaugerie L, Seksik P, Nion Larmurier I, et al. Predictors of Crohn’s disease. Gastroenterology 2006; 130: 650–656.
3. Loly C, Belaiche J, Louis E. Predictors of severe Crohn’s disease. Scand J Gastroenterol 2008; 43: 948–954.
4. Beaugerie L, Sokol H. Clinical, serological and genetic predictors of inflammatory bowel disease course. World J Gastroenterol 2012; 18: 3806–3813.
5. Panés J, Rimola J. (2017) Perianal fistulizing Crohn’s disease: pathogenesis, diagnosis and therapy. Nat Rev Gastroenterol Hepatol doi: https://doi.org/10.1038/nrgastro.2017.104
6. Schwartz DA, Wiersema MJ, Dudiak KM, et al. A comparison of endoscopic ultrasound, magnetic resonance imaging, and examunder anesthesia for evaluation of Crohn’s perianal fistulas. Gastroenterology 2001; 121: 1064–1072.
7. Schwartz DA, Ghazi LJ, Regueiro M, et al. Guidelines for the multidisciplinary management of Crohn’s perianal fistulas: summary statement. Inflamm Bowel Dis 2015; 21: 723–30.
8. FicheraA, Zoccali M. Crohn’s & Colitis Foundation of America, Inc. Guidelines for the surgical treatment of Crohn’s perianal fistulas. Inflamm Bowel Dis 2015; 21: 753–8. doi: https://doi.org/10.1097/MIB.0000000000000378
9. Tozer PJ, Burling D, GuptaA, et al. Review article: medical, surgical and radiological management of perianal Crohn’s fistulas. Aliment Pharmacol Ther 2011; 33: 5–22. doi: https://doi.org/10.1111/j.1365-2036.2010.04486.x
10. Khan KJ, Ullman TA, Ford AC, et al. Antibiotic therapy in inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 661–673.
11. Dewint P, Hansen BE, Verhey E, et al. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn’sdisease: a randomised, double blind, placebo controlled trial (ADAFI). Gut 2014; 63: 292–299.
12. Su JW, Ma JJ, Zhang HJ. Use of antibiotics in patients with Crohn’s disease: a systematic review and meta-analysis. J DigDis 2015; 16: 58–66.
13. West RL, van der Woude CJ, Hansen BE, et al. Clinical and endosonographic effect of ciprofloxacin on the treatment of perianal fistulae in Crohn’s disease with infliximab: a double blind placebo controlled study. Aliment Pharmacol Ther 2004; 20: 1329–1336.
14. Pearson DC, May GR, Fick GH, et al. Azathioprine and 6-mercaptopurine in Crohn-disease. A meta-analysis. Ann Intern Med 1995; 123: 132–42.
15. Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999; 340: 1398–405. doi: https://doi.org/10.1056/NEJM199905063401804
16. Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004; 350: 876–85. doi: https://doi.org/10.1056/NEJMoa030815
17. Colombel JF, Schwartz DA, Sandborn WJ, et al. Adalimumab for the treatment of fistulas in patients with Crohn’s disease. Gut 2009; 58: 940–8. doi: https://doi.org/10.1136/gut.2008.159251
18. Lichtenstein GR, Yan S, Bala M, et al. Infliximab maintenance treatment reduces hospitalizations, surgeries, and procedures in fistulizing Crohn’s disease. Gastroenterology 2005; 128: 862–869.
19. Panaccione R, Colombel JF, Sandborn WJ, et al. Adalimumab maintains remission of Crohn’s disease after up to 4 years of treatment: data from CHARM and ADHERE. Aliment Pharmacol Ther 2013; 38: 1236–1247.
20. Ford AC, Sandborn WJ, Khan KJ, et al. Efficacy of biological therapies in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 644–659.
21. Moore C, Corbett G, MossA C. Systematic review and meta-analysis: serum infliximab levels during maintenance therapy and outcomes in inflammatory bowel disease. J Crohns Colitis 2016; 10: 619–25. doi: https://doi.org/10.1093/eccojcc/jjw007
22. Strik AS, Lowenberg M, Ponsioen CI, et al. Higher infliximab and adalimumab serum levels correlate with perianal fistula closure in Crohn’s disease. Presented at UEGW 2017. OP 183.
23. ParulTandon, GlaraGaeun Rhee, David Schwartz & Jeffrey D. McCurdyStrategies to Optimize Anti-tumor Necrosis Factor Therapy for Perianal Fistulizing Crohn’s Disease: A Systematic Review. Digestive Diseases and Sciences 2019; 64: p. 3066–3077.
24. Dewint P, Hansen BE, Verhey E, et al. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn’s disease: a randomised, double blind, placebo controlled trial (ADAFI). Gut 2014; 63: 292–9. doi: https://doi.org/10.1136/gutjnl 2013-304488
25. Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362: 1383–95. doi: https://doi.org/10.1056/NEJMoa0904492
26. Sandborn WJ, Feagan BG, Rutgeerts P, et al. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2013; 369: 711–21. doi: https://doi.org/10.1056/NEJMoa1215739
27. Tadbiri S, Grimaud JC, Peyrin Biroulet L, et al. Efficacy of vedolizumab in extraintestinal manifestation in patients with inflammatory bowel diseases: a post hoc analysis of the OBSERV IBD cohort of the GETAID. Gastroenterology 2017; 152: S396.
28. Vedolizumab for perianal Crohn’s disease: a multicentre cohort study in 151 patientsChapuis Biron C, Bourrier A, Nachury M, et al. Aliment Pharmacol Ther 2020; 51: 719–727.
29. FeaganBG, SandbornWJ, GasinkC, et al. Ustekinumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2016; 375: 1946–60.
30. Sands BE, Gasink C, Jacobestein D, et al. Fistula Healing in Pivotal Studies of Ustekinumab in Crohn’s Disease. Presented at DDW 2017. Gastroenterology 2017; 152: S185.
31. Battat R, Bessissow T, Strohl M, et al. Ustekinumab for the treatment of perianal fistulas in patients with Crohn’s disease. Poster presentation at the ECCO congress, Barcelona, 2017 (P626). J Crohns Colitis 2017: S400–1.
32. Wils P, Bouhnik Y, Michetti P, et alSubcutaneous Ustekinumab Provides Clinical Benefit for Two Thirds of Patients With Crohn’s Disease Refractory to Anti Tumor Necrosis Factor Agents. Clin Gastroenterol Hepatol 2016; 14: 242–50. doi: https://doi.org/10.1016/j.cgh.2015.09.018
33. SolimanE, El TantawiG, MatrawyK, et al. Local infliximab injection of sacroiliac joints in non-radiographic axial spondyloarthritis: Impact on clinical and magnetic resonance imaging parameters of disease activity. Mod Rheumatol 2015; 25: 421–6. doi: https://doi.org/10.3109/14397595.2014.972495
34. Alessandroni L, Kohn A, Cosintino R, et al. Local injection of infliximab in severe fistulating perianal Crohn’s disease: an open uncontrolled study. Tech Coloproctol 2011; 15: 407–12. doi: https://doi.org/10.1007/s10151-011-0759-4
35. Tonelli F, Giudici F, Asteria CR. Effectiveness and safety of local adalimumab injection in patients with fistulizing perianal Crohn’s disease: a pilot study. Dis Colon Rectum 2012; 55: 870–5. doi: https://doi.org/10.1097/DCR.0b013e31825af532
36. Panés J, García Olmo D, Van Assche G, et al. ADMIRE CD Study Group Collaborators. Expanded allogeneic adipose derived mesenchymal stem cells (cx601) for complex perianal fistulas in Crohn’s disease: a phase 3 randomised, double blind controlled trial. Lancet 2016; 388: 1281–1290.
További irodalom megtalálható a szerkesztőségben, valamint
a www.gastronews.olo.hu weboldalon.
37. Noyer CM, Brandt LJ. Hyperbaric oxygen therapy for perineal Crohn’s disease. Am J Gastroenterol 1999; 94(2): 318–321.
38 Colombel JF, Mathieu D, Bouault JM, et al. Hyperbaric oxygenation in severe perineal Crohn’s disease. Dis Colon Rectum 1995; 38(6): 609–614.
39. Fukuda Y, Takazoe M, Sugita A, et al. Oral spherical adsorptive carbon for the treatment of intractable anal fistulas in Crohn’s disease: a multicenter, randomized, double blind, placebo controlled trial. Am J Gastroenterol 2008; 103(7): 1721–1729.
40. Reinisch W, Travis S, Hanauer S, Wang H, Shara N, Harris MS. AST 120 (spherical carbon adsorbent) in thetreatment of perianal fistulae in mild tomoderate Crohn’s disease: FHAST 1, a phase 3, multicenter, placebo controlled study. Inflamm Bowel Dis 2014; 20(5): 872–881.
41. Shen B. Exploring endoscopic therapy for the treatment of Crohn’s disease related fistula and abscess. Gastrointest Endosc 2017; 85: 1133–43. doi: https://doi.org/10.1016/j.gie.2017.01.025
42. Kamiński JP, Zaghiyan K, Fleshner P. Increasing experience of LIFT procedure for patients with Crohn’s disease: what have we learned? Colorectal Dis 2017; 19: 750–5.
43. Meinero P, Mori L. Video assisted anal fistula treatment (VAAFT): a novel sphincter saving procedure for treating complex anal fistulas. Tech Coloproctol 2011; 15: 417–22.doi: https://doi.org/10.1007/s10151-011-0769-2
44. Giamundo P, Geraci M, Tibaldi L, et al. Closure of fistula in ano with laser–FiLaC™: an effective novel sphincter saving procedure for complex disease. Colorectal Dis 2014; 16: 110–5. doi: https://doi.org/10.1111/codi.12440
45. Grimaud JC, Munoz Bongrand N, Siproudhis L, et al. Groupe d’Etude Thérapeutique des Affections Inflammatoires du Tube Digestif. Fibrin glue is effective healing perianal fistulas in patients with Crohn’s disease. Gastroenterology 2010; 138: 2275–81.
46. Nasseri Y, Cassella L, Berns M, et al. The anal fistula plug in Crohn’s disease patients with fistula in ano: a systematic review. Colorectal Dis 2016; 18: 351–6. doi: https://doi.org/10.1111/codi.13268
47. Yassin NA, Askari A, Warusavitarne J, et al. Systematic review: the combined surgical and medical treatment of fistulising perianal Crohn’s disease. Aliment Pharmacol Ther 2014; 40: 741–749.
48. Singh S, Ding NS, Mathis KL, et al. Systematic review with meta-analysis: faecal diversion for management of perianal Crohn’s disease. Aliment Pharmacol Ther 2015; 42: 783–792.
49. Steinhart H, Panaccione R, Targownik L, et al. Clinical Practice Guideline for the Medical Management of Perianal Fistulizing Crohn’s Disease: The Toronto Consensus. J Can Assoc Gastroenterol 2018; 1(4): 141–154.
