Összefoglaló közlemények / Review
Significance of nutritional status in inflammatory bowel disease
Summary
Our current review emphasizes the importance of monitoring nutritional status and its significance during the management of patients with inflammatory bowel disease. We aimed to summarize the available score systems and therapeutic principles based on the most recent recommendations that can be easily used in clinical practice.
Összefoglaló közleményünkben hangsúlyozzuk a tápláltsági állapot felmérésének, valamint jelentőségének fontosságát, mely a gyulladásos bélbetegek gondozásában kiemelt szerepet tölt be. Munkánk elkészítése során törekedtünk a gyakorlatban is jól használható pontrendszerek és kezelési alapelvek ismertetésére a legfrissebb ajánlásokra támaszkodva.
Bevezetés
A tápláltsági állapot az ember olyan homeosztatikus paramétereinek összességét jellemzi, amely bármilyen irányú eltolódása betegségek kialakulásához vezethet, vagy azok kórjelzője lehet. Az egyensúly negatív irányú elmozdulása (malnutríció) a szervezet szintjén minőségi vagy mennyiségi éhezést eredményez, amely ennek megfelelően hiánytüneteket hozhat létre, vagy egyéb kórállapotok szövődményeit alakíthatja ki, továbbá a mortalitási rátát is fokozhatja.
Gyulladásos bélbetegségekben (IBD) a bélfal gyulladásának eredményeképpen létrejövő felszívódási zavar előrevetíti a malnutríció lehetőségét. Ez alapján a betegség aktuális súlyosságával gyakran korrelál a beteg testtömegindexe, amely a gyulladásos aktivitás fokozódásával gyakorta csökken. A fentiek miatt ezekben a betegségekben fokozott figyelmet kell fordítani a páciens aktuális testsúlyának követésére és a hiányzó tápanyagok, vitaminok enterális, vagy akár parenterális pótlására. A megfelelő testsúlykontroll érdekében szóba jöhet különböző tápszerek adása, dietetikai tanácsadás is, viszont mindenekelőtt elengedhetetlen a multidiszciplináris ellátás és a szoros betegkövetés.
Jelen tanulmányunkban összefoglaljuk a legfrissebb ajánlásokat a megfelelő tápláltsági állapot felmérésére és monitorozására vonatkozóan, valamint részletezzük a malnutrícióhoz társuló kórképeket és az ezek ellátására, illetve megelőzésére vonatkozó ajánlásokat.
Módszerek
Munkánk során a szakirodalomban jelenleg fellelhető összefoglaló tanulmányokat és jelentősebb irányelveket, valamint ezek eredményeit foglaljuk össze az IBD-ben szenvedő betegek körében. Kitérünk a tápláltsági állapot felmérésére és jelentőségére, valamint a malnutrícióhoz társuló szövődményekre és ezek megelőzési javaslataira. Tanulmányunk alapjául szolgálnak többek között az ESPEN (European Society for Parenteral and Enteral Nutrition) tápláltsági monitorozást célzó 2002-es és 2017-es irányelvei.
Eredmények ismertetése
A tápláltsági állapot mérése
A tápláltsági állapot megítélésére vonatkozóan az ESPEN 2002-es irányelvei alapján megkülönböztetünk olyan módszereket, amelyek az aktuális tápláltsági állapot meghatározására szolgálnak, a tápláltsági állapot változását monitorozzák, az előrelátható állapotromlást kalkulálják, vagy azt mérik, hogy a betegség progressziója várhatóan milyen hatást fog gyakorolni a tápláltsági állapotra (1).
1. táblázat: A részletes szűrés pontrendszere a tápláltsági állapot felmérése során. Rizikócsoportba nem sorolható betegek: 0 pont, alacsony rizikójú betegek: 1-2 pont,
magas rizikójú beteg: 3 pont, vagy efölött
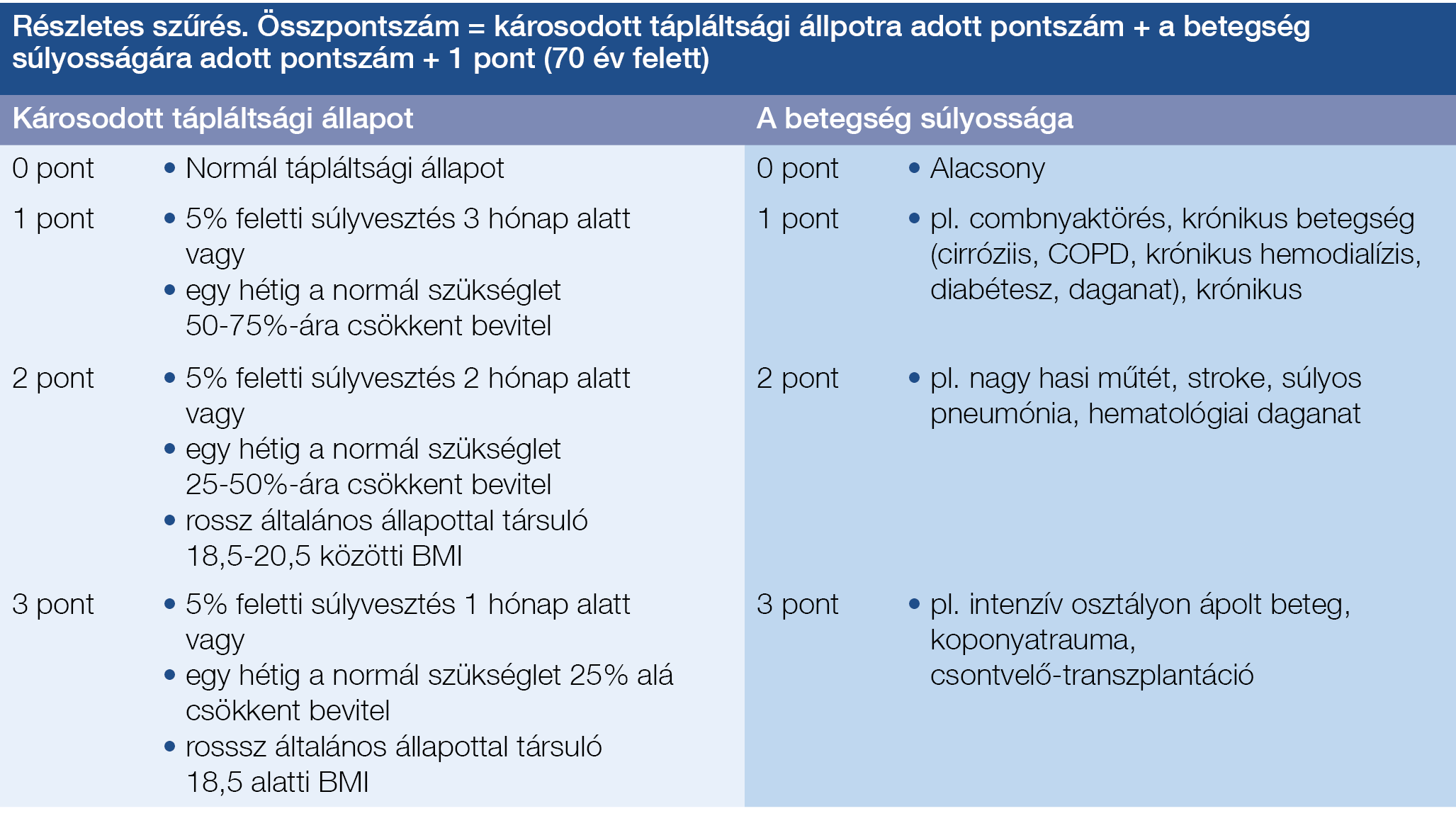
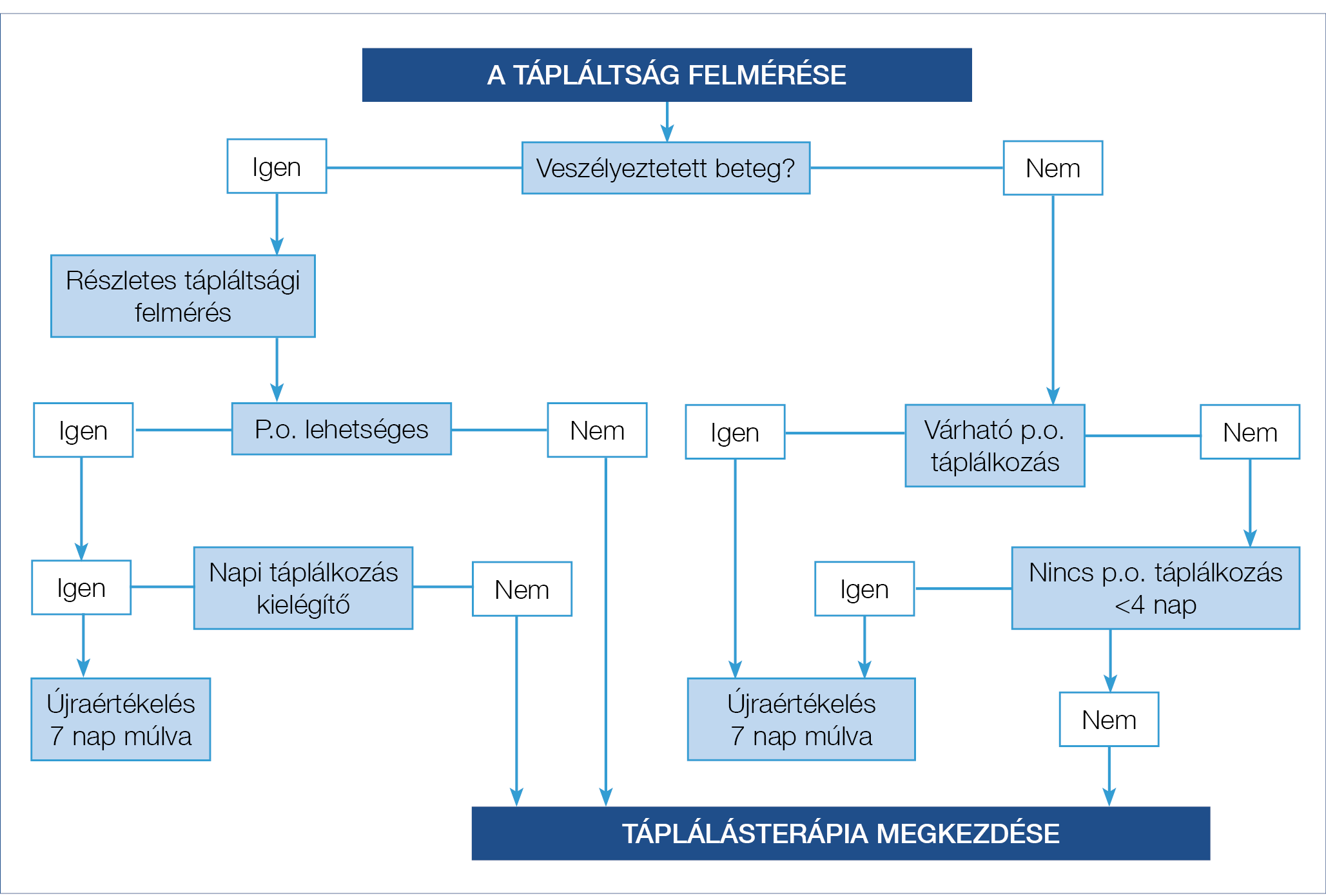
A betegek pillanatnyi tápláltságának felmérésére szolgál a testsúlymérés (ttkg), valamint a testmagasság (m) ismeretében az ebből kalkulált testtömegindex (BMI, amelynek normáltartománya 20-25 ttkg/m2), továbbá a felkar körfogatának mérése. Ezekre támaszkodva megfigyelhetjük a tápláltsági állapotban bekövetkező változásokat. A beteggel való első találkozás alkalmával fel kell mérnünk a közelmúltban bekövetkező súlyváltozásokat, továbbá meg kell ítélnünk a gondozás szükségességét és a visszarendelés időzítését. A kezdeti szűrés alkalmával a beteg állapotát a 2002-ben megjelenő Nutritional Risk Screening (NRS) szempontrendszere alapján a következőképpen kell meghatároznunk (2). Észleléskor meg kell állapítanunk, hogy a BMI 20,5 ttkg/m2 alatt van-e, az elmúlt 3 hónapban volt-e 5%-os, vagy ennél nagyobb arányú súlyvesztés, az elmúlt egy hétben csökkent-e a táplálékbevitel, továbbá áll-e fenn valamilyen súlyos alapbetegség. A fentiek bármelyikének fennállása esetén szükség van egy részletesebb szűrés elvégzésére, amellyel szenzitívebben határozható meg a páciens aktuális állapota. A részletes szűrés szempontjait az 1. táblázat foglalja össze. Ez alapján a rizikócsoportba nem sorolható, illetve alacsony rizikójú betegeket (0–2 pont) is követni kell, és szükség esetén újbóli állapotfelmérésnek kell alávetni. Tervezett műtéti beavatkozás esetén személyre szabottan kell megítélni a preoperatív táplálás szükségességét. Magas rizikójú beteg esetén (3 pont, vagy efölött) minden esetben táplálásterápiát kell elrendelni és hetente ellenőrizni kell a testsúly változásának mértékét és irányát. A rizikótényezők gyors felmérését és az ezzel kapcsolatos teendőket az Emberi Erőforrások Minisztériumának 2016-os javaslata alapján a 1. ábra foglalja össze (3). A táplálási terv kidolgozása kifejezetten komplex, multidiszciplináris feladat.
1. ábra: Táplálásterápia szükségességének gyors felmérésére szolgáló folyamatábra
(Forrás: Emberi Erőforrások Minisztériuma szakmai irányelve a kórházi, az egészségügyi ápolási otthonokban és az otthoni ellátásra szoruló felnőtt betegek tápláltsági állapotának felmérése és a tápláltsági zavarok táplálásterápiával történő kezeléséről. 2016. EüK. 22. szám)
A táplálás célja és eljárásrendje
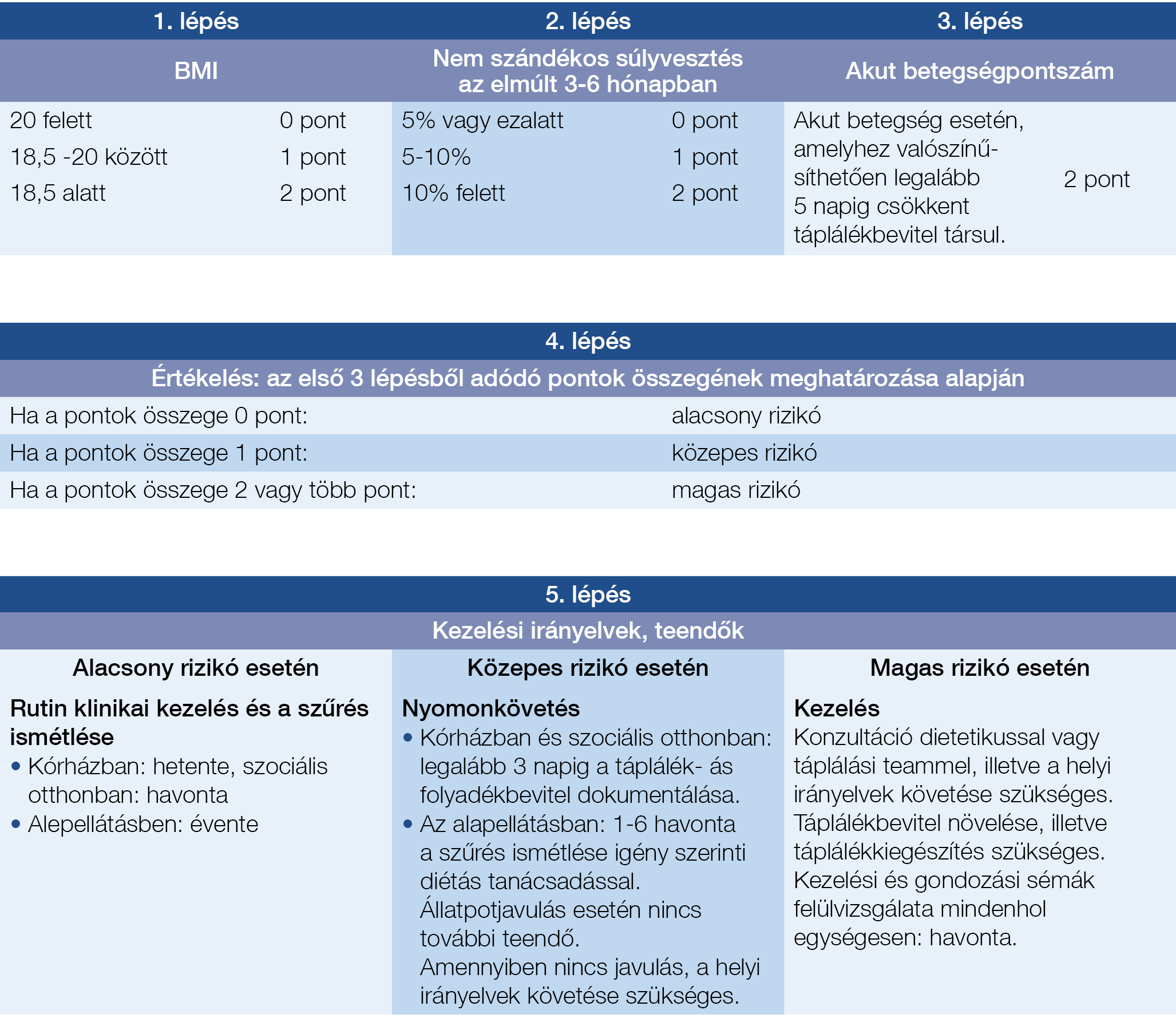
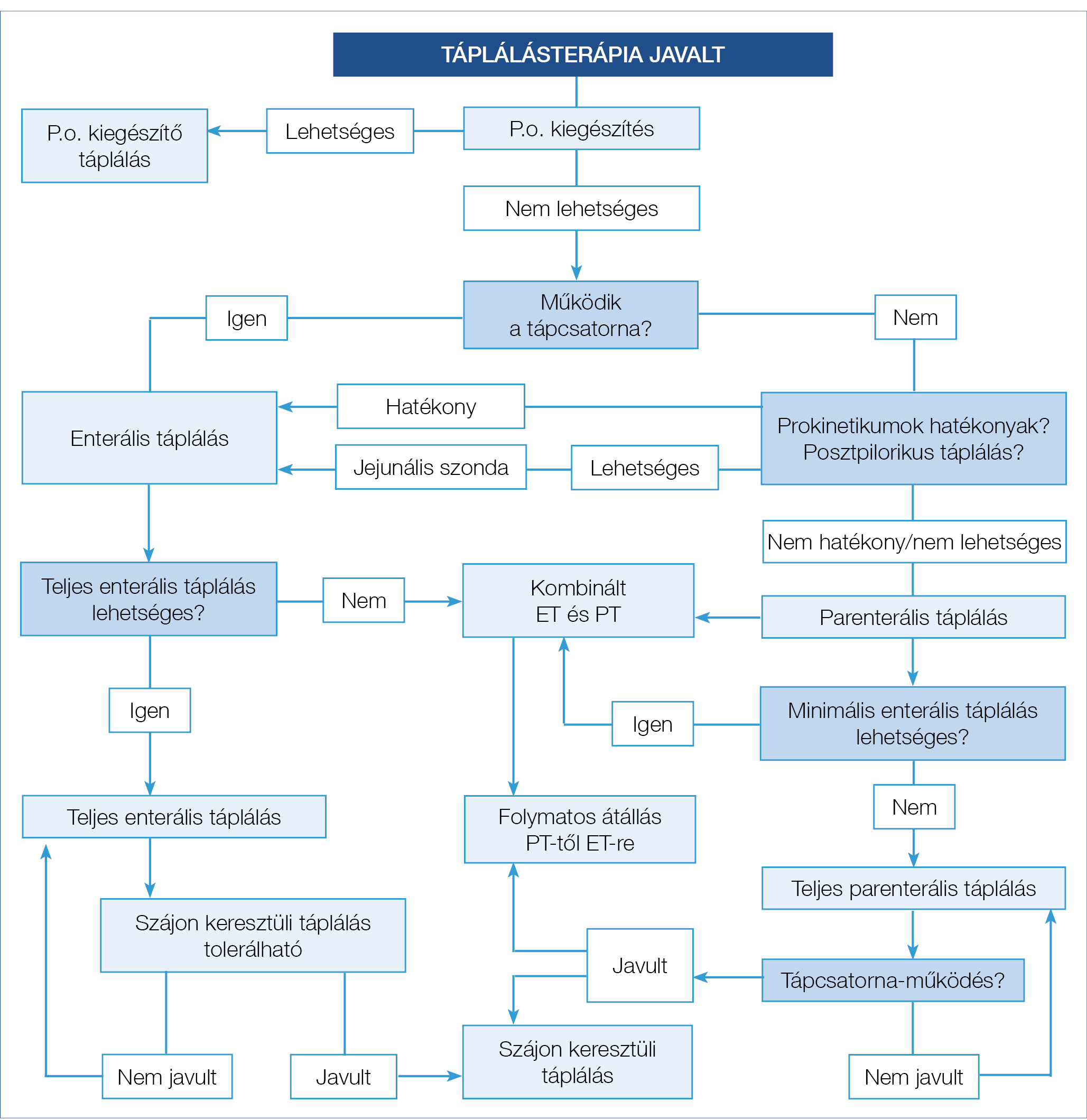
Mindenekelőtt megjegyzendő, hogy alapvető és elsődleges feladat a testsúlycsökkenés pontos okának feltárása, továbbá a társbetegségek azonosítása, hiszen tartós állapotjavulás csak ezek megfelelő kezelésével érhető el. A táplálás célja minden esetben a beteg állapotának javítása és ezen keresztül a rizikó csökkentése, valamint hiánytünetek esetén a hiányzó tápanyagok pótlása. A malnutríció mértékének megítélésére, valamint a felmerülő teendőkre és azok ütemezésére vonatkozó alapelveket a Malnutrition Universal Screening Tool for adults (MUST, 2004.) foglalja össze, amelyet részletesen a 2. táblázat mutat be. Ez a megközelítés átfogó képet ad arról, hogy mi a teendő a rutin klinikai ellátás során (4). Amennyiben malnutríciót tapasztalunk, a testsúly százalékarányos csökkenése alapján a táplálási teendőket a 3. táblázat foglalja össze (5). A táplálékbevitel legfeljebb 50%-os csökkenése energia- és fehérjedús táplálékkal, ivótápszerekkel pótolható. Ennél nagyobb deficit esetén a szondás és parenterális táplálási formák megfontolandók, míg 28 napot meghaladó alacsony bevitel esetén PEG is szóba jöhet. A részletes döntési sémát az EEM a 2. ábra szerint határozza meg. Szükséges lehet a specifikusan vesztett mikro- és makronutriensek enterális vagy parenterális pótlására is. Példának okáért ileocoecum reszekción átesett beteg esetében B12-vitamin adása, valamint vaspótlás válhat szükségessé.
2. táblázat: Alultápláltsági rizikó felmérése és az egyes esetekben ellátandó teendők – MUST (Malnutrition Universal Screening Tool)
Táplálás tekintetében a személyre szabott kezelési tervek megválasztása az EEM 2016-os D-szintű javaslata (3) alapján multidiszciplináris táplálási munkacsoport feladata. A munkacsoport összetételét tekintve olyan orvosok, dietetikusok, kórházi gyógyszerészek és szakápolók részvételére lenne szükség, akik a betegellátó egység többi munkacsoportjával aktív, napi szintű kommunikációs kapcsolatban állnak, s ezzel segítik a táplálás-specifikus döntéshozatalt.
3. táblázat: Elrendelendő táplálásterápia-formák a csökkenő táplálékbevitel alapján

A tápanyagigény meghatározása, enterális táplálás
Táplálásterápia elrendelésekor mennyiségi és minőségi szempontok egyaránt mérvadók. Az esszenciális vitaminok és ásványi anyagok megfelelő bevitele mellett ügyelnünk kell mind a megfelelő energiabevitelre, mind pedig a fehérjebevitelre. Az alapanyagcsere energiaszükséglete ≥60 éves beteg és/vagy ≥25 ttkg/m2-es BMI esetén a napi beviteli érték 20 kcal/ttkg/nap alapján számítandó. Ez az érték 60 év és/vagy 25 ttkg/m2-es BMI alatt 25 kcal/ttkg/nap alapján határozandó meg. Mivel az alapvető energiaszükséglet az alapanyagcsere függvénye, a betegellátás során számos egyéb tényező módosíthatja ezt. Kórházi tartózkodás esetén a beteg aktivitását is figyelembe kell venni: immobilizált beteg esetén az előbbiek alapján számolt energiaszükségletet fel kell szorozni 1,2-vel, míg alacsony aktivitású beteg esetén ez a szorzó 1,5-re, közepes aktivitású beteg esetén pedig 1,75-re módosul (6). A kórházi kezelést indokló állapottól függően ez a szorzó 1,0 (szövődménymentes posztoperatív állapot) és 2,0 (kiterjedt égési sérülés) között változhat (7), mivel a különböző kórállapotok fokozott metabolizmust eredményeznek.
A tápláltsági állapot jelentősége gyulladásos bélbetegségekben és a táplálás javaslatai
A gyulladásos bélbetegségekre vonatkozó táplálási ajánlásokat a továbbiakban az ESPEN 2017-es ajánlásai (8) alapján tárgyaljuk, amelyeket 40 főbb pontba szedve, multidiszciplináris szempontok alapján határoztak meg. Munkájuk során a szakirodalom összefoglaló jellegű közleményeire támaszkodtak, amelyet kiegészítettek szakértői javaslatokkal és kommentekkel. Az ajánlások elkészítésében közreműködött a European Crohn’s and Colitis Organization (ECCO) és a European Society for Paediatric Gastroenterology Hepatology and Nutrition (ESPGHAN) szervezete is.
2. ábra: Táplálásterápia javaslataira vonatkozó döntési séma
(Forrás: Emberi Erőforrások Minisztériuma szakmai irányelve a kórházi, az egészségügyi ápolási otthonokban és az otthoni ellátásra szoruló felnőtt betegek tápláltsági állapotának felmérése és a tápláltsági zavarok táplálásterápiával történő kezeléséről. 2016. EüK. 22. szám)
Etiológia és prevenció tekintetében nagy elemszámú, prospektív kohortvizsgálatban azt találták, hogy az IBD két fenotípusa, a Crohn-betegség (CD) és a colitis ulcerosa (UC) némiképp eltérően viselkedik (9). A tanulmányban 170 776 női jelentkezőt vizsgáltak meghatározott diéta tartásával, akiket több mint 26 évig követtek. Az utánkövetési idő végéig 269 CD és 338 UC diagnózisát állították fel. Megállapították, hogy malnutríció tekintetében veszélyeztetettebb a CD-ben szenvedő, valamint a terápiarezisztens betegpopuláció (10). A testsúlycsökkenést minden esetben a lehető legsürgősebben korrigálni kell a jobb prognózis és életminőség, valamint alacsonyabb mortalitás és komplikációrizikó érdekében.
A malnutrició veszélyei
A sürgősségi osztályon megjelentek száma egy USA-beli tanulmány szerint 2009-ben és 2011-ben 102 472 és 113 993 volt, melynek 0,09%-a volt IBD-s beteg (11). Ezen megjelenések közül több mint az esetek kétharmadában, 69%-ban CD-betegek megjelenéséről számoltak be. A következményes hospitalizációkkal szignifikánsan korrelált a malnutríció (OR: 6,29), továbbá a bélobstrukció, az intraabdominális tályog, az anémia, a hypovolaemia és elektroliteltérések, valamint a láz és a fehérvérsejtek számbeli eltérései. Ezek a faktorok CD-betegek esetén gyakoribb komorbiditások voltak.
A malnutríció szintén szoros összefüggésben áll az IBD-asszociált infektív megbetegedésekkel, amelyek kialakulásában jelentős szerepe van az immunszuppresszív- és biológiai kezeléseknek. Egy másik USA területére kiterjedő tanulmány szerint 2007-ben infekcióval hospitalizált IBD-betegek körében a malnutríció független rizikófaktornak bizonyult (12). Vizsgálatukban 67 221 IBD-asszociált fertőzésindikációjú betegfelvételt találtak, amelynek során a leggyakoribb kórképek a szepszis, pneumónia, Clostridium difficile fertőzés voltak, amelyek a mortalitást is növelték. Kisebb mértékben húgyúti infekciók is megjelentek. Megállapították továbbá, hogy a gyulladásos bélbetegek hospitalizációjának 27,5%-át adják ezek a kórképek. Fertőzések tekintetében a malnutríción túli egyéb független rizikófaktorokként az életkort, a totális parenterális táplálást, társbetegségek fennállását és sebészeti beavatkozásokat jelölték meg.
4. táblázat: ERAS (Enhanced Recovery After Surgery) protokoll
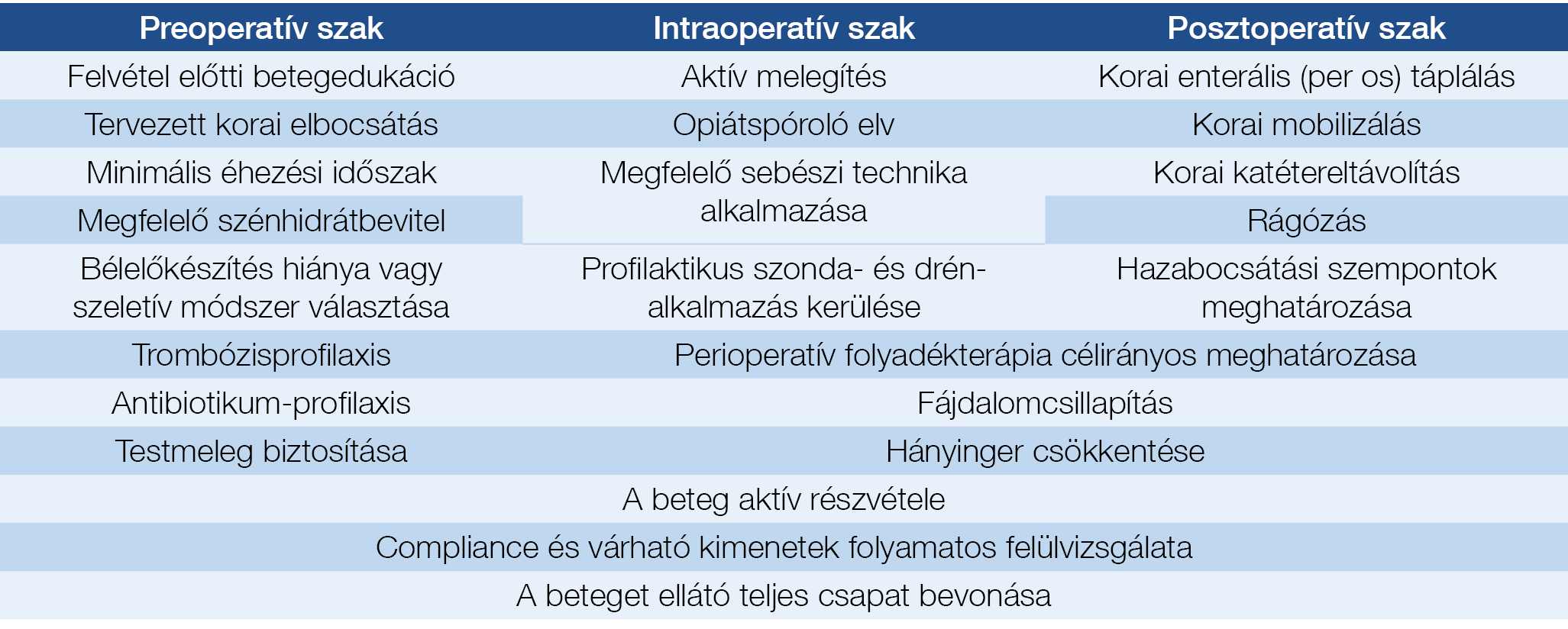
Hasi műtétek tekintetében a preoperatív időszakban csökkent táplálékbevitel a posztoperatív szövődmények kialakulásának független rizikótényezője (13). Érthető okokból ebben a témakörben nem születtek prospektív vizsgálatok, a retrospektív vizsgálatok eredményei alapján azonban az egyértelmű, hogy a műtétet megelőző legalább 14 napos elégtelen táplálékbevitel magasabb mortalitással társul (14). Sürgős műtéti beavatkozások tekintetében az ESPEN ajánlásai szerint posztoperatív enterális vagy parenterális táplálást kell bevezetni minden olyan esetben, amikor a műtét előtt malnutríciót tapasztalunk, vagy pedig a műtét után várhatóan 7 napig nem kezdhető majd meg orális táplálás. Elektív műtétek esetében az ERAS (enhanced recovery after surgery) (4. táblázat) protokoll követendő, amely funkcionális szempontokat vesz figyelembe, s ezáltal fő célja a gasztrointesztinális rendszer megfelelő működésének visszanyerése (15). CD tekintetében kiemelkedő fontosságú a korai posztoperatív, azaz 24 órán belüli enterális táplálás megkezdése, ugyanis ez bizonyítottan csökkenti a posztoperatív szövődmények kialakulását (16, 17). Kiemelendő a trombózisprofilaxis fontossága is, mivel malnutríció esetén a posztoperatív tromboembólia kialakulásának esélye is magasabb (18). Egy retrospektív vizsgálat 10 431 IBD-s betegen elvégzett műtétet elemzett (52,1% CD, 47,9% UC betegen), és 242 vénás tromboembóliás szövődményt találtak. Eredményeik szerint rizikófaktort jelentett a malnutríció, valamint emellett a vérzési rendellenesség, a szteroidhasználat, az altatási idő, a sürgősségi műtéti beavatkozás és a 37% alatti hematokritszint is.
A malnutríció prevenciója
Napi energiaszükséglet tekintetében az IBD-s betegek igényei nem különböznek a nem-IBD-s populációtól, azonban a mikronutriensek és a vitaminok vesztése a gasztrointesztinális traktuson keresztül az aktivitás függvényében jelentős lehet. Ezért különösképpen ügyelni kell a megfelelő energiabevitelre és a változatos táplálkozásra, szükség esetén az ásványianyagok, nyomelemek és vitaminok pótlására. Mindenekelőtt korrigálni kell a vashiányt és az anémiát, mivel az ezzel kapcsolatos késlekedések további állapotromláshoz vezethetnek. Az anémia prevalenciája 6 és 74%, azaz széles határok között változhat (19). Aktív betegség esetén folyamatosan ellenőrizni kell a hemoglobin- és vasszintet, s intravénás vaspótlásra is sor kerülhet, míg inaktív betegség esetén elsővonalbeli kezelés az orális vaspótlás. Fehérjeszükséglet tekintetében ügyelnünk kell arra, hogy aktív IBD-ben a normál- és remisszióban lévő populációhoz képest emelkedett szükséglettel kell számolnunk, ezért aktivitási tünetek esetén 1,2-1,5 g/ttkg/napra emelkedik az ajánlott fehérjebeviteli érték. Szót kell ejtenünk arról is, hogy obes beteg esetén az ajánlásokban a testsúlycsökkentés csak akkor szerepel, ha az IBD tartósan remisszióban van.
Gyermekgyógyászati vonatkozásban IBD-prevenciós szempont az anyatejes táplálás, továbbá elengedhetetlen az elégséges táplálékbevitel, valamint a megfelelő tápanyag-összetételű táplálék biztosítása is. Gyermek- és serülőkorban a tápláltsági állapot felmérésére a korábban említett módszerek helyett a gyakorlatban a Z-score és a BMI Z-score rendszereket alkalmazzuk, továbbá fontos az esetükben alkalmazandó szteroidhasználat kapcsán a csontsűrűség ellenőrzése is. A gyermekgyógyászatban gondos körültekintést igényel a hosszú időn át fennálló elégtelen táplálkozás után a táplálékbevitel fokozatos növelése is olyan célból, hogy elkerüljük az akár letális újratáplálási szindrómát. Ügyelnünk kell a folyadék- és elektrolitháztartás változásaira, különösen a foszfát- és tiaminszintekre (20–22).
Megbeszélés
Ezen eredmények ismeretében egyértelmű, hogy a tápláltsági állapot felmérése és annak folyamatos ellenőrzése elengedhetetlen feladat a gyulladásos bélbetegek gondozása során. Törekednünk kell a betegek normál tápláltsági állapotának fenntartására, amelyet az energia- és tápanyagbevitel pontos meghatározása, és ezek megfelelő biztosításával érhetünk el. A malnutríció és a hozzá társuló kórképek súlyos, akár életet veszélyeztető állapotokat is létrehozhatnak, amelyek megelőzése és ellátása multidiszciplináris feladat. Megfelelő ellátással és szoros betegkövetéssel következményesen csökkenthető a hospitalizációk száma, amely további szövődmények elkerülését eredményezheti, valamint a fekvőbeteg-ellátó intézmények leterheltségét is csökkenti. Mindemellett ügyelnünk kell az IBD kezelése során alkalmazott gyógyszerek esetleges előre látható mellékhatásaira is, amelyek további állapotromláshoz vezethetnek. Összegzésként elmondhatjuk továbbá, hogy körültekintő szakmai háttérrel az IBD-s betegek tápláltsági állapota alapvetően jól követhető, továbbá hogy a malnutríció és szövődményeinek megelőzésére számos, könnyen elérhető eszköz áll rendelkezésünkre.
2. Kondrup J, Rasmussen HH, Hamberg O, et al. Nutritional Risk Screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003; 22: 321–336.
3. Az Emberi Erőforrások Minisztériuma szakmai irányelve a kórházi, az egészségügyi ápolási otthonokban és az otthoni ellátásra szoruló felnőtt betegek tápláltsági állapotának felmérése és a tápláltsági zavarok táplálásterápiával történő kezeléséről. 2016. EüK. 22. szám
4. A Guide to the ‘Malnutrition Universal Screening Tool’ (‘MUST’) for Adults. Malnutrition Action Group (MAG). 2004. (2011-ben megerősítve).
5. The Dutch Approach on Malnutrition – Early detection and treatment of malnutrition in hospital. Dutch Malnutrition Steering Group. 2012. www.fightmalnutrition.eu
6. Human energy requirements. FAO/WHO/UNU Szakértői Konzultáció egyesített ajánlása 2004. (2009-ben megerősítve).
7. Klinikai Táplálás Osztrák Munkabizottságának (AKE) 2008–2010. irányelvei.
8. Forbes A, Escher J, Hébuterne X, et al. ESPEN guideline: Clinical nutrition in inflammatory bowel disease. Clin Nutr 2017 Apr; 36(2): 321–347. doi: https://doi.org/10.1016/j.clnu.2016.12.027. Epub 2016 Dec 31
9. Hou JK, Abraham B, El-Serag H. Dietary intake and risk of developing inflammatory bowel disease: a systematic review of the literature. Am J Gastroenterol 2011; 106: 563e73.
10. Nguyen GC, Munsell M, Harris ML. Nationwide prevalence and prognostic significance of clinically diagnosable protein-calorie malnutrition in hospitalized inflammatory bowel disease patients. Inflamm Bowel Dis 2008; 14: 1105e11.
11. Gajendran M, Umapathy C, Loganathan P, et al. Analysis of Hospital-Based Emergency Department Visits for Inflammatory Bowel Disease in the USA. Dig Dis Sci 2016. doi: https://doi.org/10.1007/s10620-015-3895-2
12. Ananthakrishnan AN, McGinley EL. Infection-related hospitalizations are associated with increased mortality in patients with inflammatory bowel diseases. Journal of Crohn’s and Colitis 2013; 7: 107–112.
13. Kuppinger D, Hartl WH, Bertok M, et al. Nutritional screening for risk prediction in patients scheduled for abdominal operations. British Journal of Surgery 2012; 99: 728–737.
14. Sandstrom R, Drott C, Hyltander A, Arfvidsson B, Schersten T, Wickstrom I, et al. The effect of postoperative intravenous feeding (TPN) on outcome following major surgery evaluated in a randomized study. Ann Surg 1993; 217: 185e95.
15. Pędziwiatr M, Mavrikis J, Witowski J, et al. Current status of enhanced recovery after surgery (ERAS) protocol in gastrointestinal surgery. Medical Oncology 2018; 35: 95. doi: https://doi.org/10.1007/s12032-018-1153-0
16. Andersen HK, Lewis SJ, Thomas S. Early enteral nutrition within 24h of colorectal surgery versus later commencement of feeding for postoperative complications. Cochrane Database Syst Rev 2006. CD004080.
17. Lewis SJ, Andersen HK, Thomas S. Early enteral nutrition within 24 h of intestinal surgery versus later commencement of feeding: a systematic review and meta-analysis. J Gastrointest Surg 2009; 13: 569e75.
18. Wallaert JB, DeMartino RR, Marsicovetere PS, et al. Venous Thromboembolism After Surgery for Inflammatory Bowel Disease: Are There Modifiable Risk Factors? Data from ACS NSQIP. Dis Colon Rectum. 2012 November ; 55(11): 1138–1144. doi: https://doi.org/10.1097/DCR.0b013e3182698f60
19. Reinisch W, Staun M, Bhandari S, Munoz M. State of the iron: how to diagnose and efficiently treat iron deficiency anaemia in inflammatory bowel disease. J Crohns Colitis 2013; 429e40.
20. Akobeng AK, Thomas AG. Refeeding syndrome following exclusive enteral nutritional treatment in Crohn disease. J Pediatr Gastroenterol Nutr 2010; 51: 364e6.
21. Hernando A, Breton I, Marín-Jimenez I, Menchen L. Refeeding syndrome in a patient with Crohn’s disease. J Clin Gastroenterol 2008; 4: 430e1.
22. Krznaric Z, Vranesic Bender D, Ljubas Keleric D et al. Wernicke’s encephalopathy during parenteral nutrition in a Crohn’s disease patient. Nutrition 2011; 27: 503e4.
